ФІЗИКА ДЛЯ БАКАЛАВРІВ. МОЛЕКУЛЯРНА ФІЗИКА ТА ТЕРМОДИНАМІКА
IV. ПЕРШЕ НАЧАЛО ТЕРМОДИНАМІКИ
Викладені вище відомості про властивості газів добре ілюструють сутність і можливості молекулярно-кінетичного (статистичного) методу (МКТ). Але, як вже говорилося, в молекулярній фізиці широко використовується й термодинамічний метод дослідження, що ґрунтується на декількох основних законах – началах термодинаміки. Ці закони, встановлені дослідним шляхом, відображають такі зв’язки між макроскопічними характеристиками системи, які не пов’язані з її мікроскопічною будовою. Тому закони термодинаміки та всі наслідки, що з них випливають, є універсальними, тобто, чинними для будь-яких систем. Слід також зауважити, що закони термодинаміки мають не лише теоретичне, а й велике практичне значення, оскільки лежать в основі отримання та використання людством різних видів енергії[1].
У термодинаміці, крім параметрів стану, використовують й інші термодинамічні величини. Найперше це стосується внутрішньої енергії, теплоти та роботи.
Нижче розглянуті наступні питання:
2. Макроскопічна робота та теплота
У широкому розумінні до внутрішньої енергії довільної фізичної системи входять усі види енергії, крім кінетичної енергії руху системи як цілого та її потенціальної енергії у зовнішніх полях. Стосовно речовини внутрішня енергія включає кінетичну енергію руху молекул відносно центра мас системи (інакше – теплового руху), потенціальну енергію взаємодії між молекулами, а також енергію руху та взаємодії атомів усередині молекули.
Внутрішня енергія одноатомного ідеального газу. В найпростішій термодинамічній системі - одноатомному ідеальному газі – внутрішня енергія U складається тільки з кінетичної енергії теплового руху атомів і дорівнює добутку кількості частинок N на середню кінетичну енергію однієї частинки \(\langle{E}\rangle\) . Згідно з (1.1), (1.1а), (1.2), (2.5),
|
\({U}=\frac{3}{2}\nu{RT}=\frac{3}{2}\cdot\frac{m}{M}{RT}\). |
(4.1) |
Для одного моля
|
\({U}=\frac{3}{2}{RT}\). |
(4.1а) |
Урахувавши рівняння Клапейрона (2.6), маємо ще один вираз U:
|
\({U}=\frac{3}{2}{PV}\). |
(4.2) |
Записані вирази відображають дуже важливу властивість внутрішньої енергії не лише ідеального газу, а й будь-якої іншої термодинамічної системи. Ця властивість полягає в тому, що
внутрішня енергія однозначно визначається параметрами стану системи.
Відповідно, зміна внутрішньої енергії системи в будь-якому процесі визначається тільки зміною параметрів стану. До прикладу, при переведенні одноатомного газу зі стану 1 (\({P_1,\,V_1,\,T_1,\,}\)) у стан 2 (\({P_2,\,V_2,\,T_2}\)) зміна внутрішньої енергії складає
|
\(\Delta{U}=U_1-U_1=\frac{3}{2}\cdot\frac{m}{M}R(T_2-T_1)=\frac{3}{2}\cdot\frac{m}{M}R\Delta{T}\) |
(4.3) |
або
|
\(\Delta{U}=\frac{3}{2}(P_2 V_2-P_1 V_1) \). |
(4.3а) |
Отже, зміна внутрішньої енергії не залежить від процесу, тобто, способу переведення системи з одного стану в інший. Тому говорять, що
внутрішня енергія є функцією стану системи.
Ступені свободи. Молекули одноатомного ідеального газу не мають якоїсь конфігурації й можуть рухатися тільки поступально. У випадку складніших молекул при визначенні внутрішньої енергії необхідно враховувати й інші види їхніх рухів як цілого, а також рухи та взаємодію атомів усередині молекули. Для цього використовують поняття кількості ступенів свободи.
Кількістю ступенів свободи і системи (молекули) називається кількість незалежних координат, яка є необхідною для однозначного визначення положення молекули в просторі.
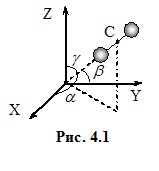
Зміна координат означає рух, отже, можна сказати, що кількість ступенів свободи молекули визначає кількість різних рухів, які вона може здійснювати. До прикладу, поступальний рух тіла визначається зміною з часом трьох координат центра мас. Відповідно, кожна молекула, в тому числі й одноатомна, має iп = 3 поступальні ступені свободи. Для визначення положення жорсткої лінійної молекули[2] (рис. 4.1), окрім положення центра мас, необхідно вказати напрям її осі. Для цього треба задати ще дві координати, наприклад, кути α і β, що їх утворює вісь молекули з двома осями декартової системи (третій кут γ однозначно визначається через два інших умовою: cos2α + cos2β + cos2γ = 1). Зміна цих кутів визначає обертання молекули навколо двох осей, перпендикулярних до осі молекули[3]. Тому жорстка лінійна молекула має iоб = 2 обертальні ступені свободи й повну кількість ступенів свободи i = iп + iоб = 5.
|
|
У випадку жорсткої молекули, що складається з трьох і більше атомів, які не лежать на одній осі, є ще один можливий рух - обертання навколо осі, що проходить через будь-які два атоми. Тому багатоатомна жорстка молекула має iоб = 3 обертальні ступені свободи й повну кількість ступенів свободи і = 6. Якщо в системі з N частинок між ними немає жорсткого зв’язку, то положення кожної частинки треба задавати окремо, через що повна кількість ступенів свободи системи і = 3N. Ця кількість, окрім поступальних і обертальних ступенів свободи, що визначають рух системи як цілого, включає також ступені свободи, які пов’язані з рухом частинок системи відносно центра мас. Як відзначалося на початку цього розділу (п. 1.3), атоми в молекулах зв’язані пружними силами й здійснюють коливальний рух, тому вказані додаткові ступені свободи молекул називаються коливальними. Кількість коливальних ступенів свободи дорівнює різниці між повною кількістю ступенів свободи молекули та сумарною кількістю поступальних і обертальних ступенів свободи: iкол = i - (iп + iоб) . Коливальні ступені свободи молекули визначаються кількістю та конфігурацією атомів, із яких вона складається. При цьому для лінійної молекули з N атомів iкол = 3N - 5, а для всіх інших конфігурацій iкол = 3N - 6. Наприклад, для двохатомної пружної молекули кількість коливальних ступенів свободи iкол = 3·2 - 5 = 1, для трьохатомної лінійної iкол = 3·3 - 5 = 4, а для трьохатомної “трикутної” - iкол = 3·3 - 6 = 3.
Розподіл енергії за ступенями свободи. Згідно з (1.2), середня кінетична енергія поступального руху одноатомної молекули (матеріальної точки) дорівнює
\(\langle{E_n}\rangle=\frac{i_n}{2}{kT}\),
де \({i_n = 3}\) - кількість поступальних ступенів свободи. Отже, на кожен поступальний ступінь свободи припадає середня кінетична енергія, що дорівнює kT/2. Л. Больцман довів, що це вірно й для кінетичної енергії обертального та коливального руху частинок. У цьому полягає класичний закон рівнорозподілу енергії по ступенях свободи:
у стані термодинамічної рівноваги на кожен ступінь свободи системи припадає однакова середня кінетична енергія
\(\langle{E_1}\rangle=\frac{1}{2}{kT}\).
Це зводить проблему визначення внутрішньої енергії довільної системи до підрахунку кількості її ступенів свободи. Правда, розглядаючи внесок в енергію рухів атомів усередині молекули, треба враховувати не лише кінетичну, а й потенціальну енергію їхньої взаємодії. Але це не складно, оскільки коливання атомів у молекулах близькі до гармонічних, а за таких умов середні значення кінетичної та потенціальної енергії коливань виявляються однаковими. Тож середня енергія, що припадає на один коливальний ступінь свободи, дорівнює двом половинкам kT. Через це, при підрахунках, кількість коливальних ступенів свободи подвоюють і обчислюють середню енергію молекули за загальною формулою
|
\(\langle{E}\rangle=\frac{i}{2}{kT}\), |
(4.4) |
де величина і визначається виразом:
|
\({i = i_n+i}\)об + \({2i}\)кол. |
(4.5) |
Відповідно до сказаного, для визначення внутрішньої енергії довільного ідеального газу в (4.1), (4.1а) і (4.2) трійку треба замінити на \({i}\):
|
\({U}=\frac{i}{2}\nu{RT}=\frac{i}{2}\cdot\frac{m}{M}{RT}\), |
(4.6) |
|
|
\({U_m}=\frac{i}{2}{RT}\), |
(4.6а) |
|
|
\({U}=\frac{i}{2}{PV}\). |
(4.7) |
Для інших термодинамічних систем, зокрема для реальних газів, ці формули не підходять, оскільки вони не враховують потенціальну енергію взаємодії між молекулами.
2. Макроскопічна робота та теплота
Фізичні процеси завжди супроводжуються обміном енергією між тілами та її перетвореннями з одних видів на інші. Зокрема, в термодинамічних процесах, за винятком ізотермічних, змінюється внутрішня енергія системи. Внутрішню енергію можна змінювати різними конкретними способами, але є тільки дві різні причини такої зміни. Це – виконання макроскопічної роботи та теплообмін.Макроскопічна робота. Добре відомо, що при швидкому стисканні газу в циліндрі під поршнем його температура, отже й внутрішня енергія, значно зростає[4]. Це пояснюється тим, що при русі поршня молекули газу після зіткнення з ним отримують додатковий імпульс і відлітають із більшими швидкостями, ніж підлітають. З іншого боку, для стискання газу до поршня має бути прикладена зовнішня сила, яка при переміщенні поршня виконує відповідну макроскопічну роботу[5].
|
|
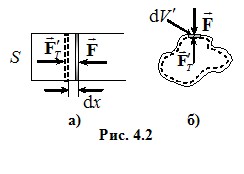
Розглянемо стискання газу в циліндрі з поршнем площею S під дією зовнішньої сили \(\vec{F}\) (рис 4.2 а), вважаючи, що стискання відбувається квазістатично (рівноважно). При переміщенні поршня на нескінченно малу відстань dx сила F виконує елементарну роботу δA′ = Fdx. Оскільки процес є рівноважним, зовнішня сила за модулем дорівнює силі тиску газу на поршень Fт = PS (Р - тиск). Отож, F = PS, і робота δA′ = PSdx, або
|
δA = – PdV, |
(4.8) |
dV - зміна об’єму газу, знак “-” стоїть тому, що δA′ > 0, коли dV < 0, і навпаки. Відповідно, газ виконує таку саму по модулю, але протилежну за знаком роботу
|
δA = – δA′ = PdV. |
(4.8а) |
Отримані вирази є чинними й у загальному випадку. Це легко довести. Нехай газ міститься в еластичній оболонці довільної форми (рис 4.2 б). При нескінченно малому переміщенні dl якоїсь однієї елементарної ділянки оболонки площею dS газ виконує роботу PdV′, де dV′ = dS·dl - часткова зміна об’єму газу, зумовлена переміщенням цієї ділянки. Оскільки тиск газу в усіх точках однаковий, робота, зумовлена елементарним переміщенням усіх ділянок δA = PdV, де dV – сума всіх dV′, тобто елементарний приріст об’єму всього газу. Отже, в термодинаміці робота пов’язана не з переміщенням системи як цілого, а із зміною її об’єму, тобто – із переміщенням стінок, які відокремлюють систему від оточення.
У процесі стискання або розширення газу тиск, на загал, не лишається сталим. Тому при скінченній зміні об’єму газу робота зовнішніх сил A′ та робота газу A визначаються інтегруванням виразів (4.8) і (4.8 а):
|
A′ = \( -\int{P\mathrm{d}V}\). |
(4.9) |
|
|
\({A}=\int{P\mathrm{d}V}\). |
(4.9а) |
Обчислення роботи газу в різних процесах.
В ізохорному (V = const) процесі dV = 0, і робота не виконується: δA = 0.
В ізобарному процесі Р = const і при зміні об’єму від V1 до V2 газ, згідно з (4.9), виконує роботу
|
\({A}=\int\limits_{V_1}^{V_2}P\mathrm{d}V=P\int\limits_{V_1}^{V_2}\mathrm{d}V \) \(\Rightarrow \) \({A}=P(V_2-V_1)=P\Delta{V}\). |
(4.10) |
Робота зовнішніх сил над газом визначається, як
|
A′ = P(V1 - V2) = –PΔV. |
(4.10а) |
За допомогою рівняння Клапейрона (2.6) роботу газу в ізобарному процесі можна виразити й через зміну температури:
|
\({A}=\nu{R}(T_2-T_1)=\nu{R\Delta{T}}\). |
(4.10б) |
В ізотермічному процесі Т = const. Урахувавши це та, підставивши в (4.9) вираз тиску з рівняння Клапейрона (2.6), отримаємо для роботи газу при ізотермічній зміні об’єму від V1 до V2:
|
\({A}=\nu{RT}\int\limits_{V_1}^{V_2}\frac{\mathrm{d}V}{V}=\nu{RT}\ln\frac{V_2}{V_1}=\frac{m}{M}{RT}\ln\frac{V_2}{V_1}\). |
(4.11) |
Оскільки в ізотермічному процесі PV = const, можна також записати:
\({A}=\nu{RT}\ln\frac{P_1}{P_2}=\frac{m}{M}{RT}\ln\frac{P_1}{P_2}\).
Робота зовнішніх тіл над газом при незмінній температурі, відповідно до (4.9), виражається як
|
A′ = \(\nu{RT}\ln\frac{V_1}{V_2}\). |
(4.11а) |
|
|
|
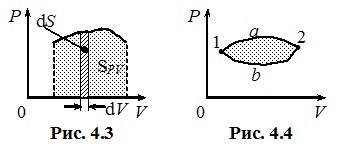
Термодинамічна робота має простий геометричний зміст. На рис. 4.3 показано графік якогось процесу на діаграмі Р-V (“у координатах” (P, V)). Видно, що при нескінченно малій зміні об’єму робота газу δA = PdV чисельно дорівнює площі dS смужки ширини dV під графіком процесу. Так само, робота при скінченній зміні об’єму від V1 до V2 чисельно дорівнює всій площі S під відповідною ділянкою графіка процесу на діаграмі (P, V):
A = SPV.
Такий геометричний підхід, звичайно, не знімає необхідності обчислення інтегралів (4.9) при визначенні роботи (крім випадку лінійної залежності P(V)), але він є дуже зручним для якісного аналізу термодинамічних процесів. Наприклад, він дозволяє легко зрозуміти важливу обставину: на відміну від внутрішньої енергії, макроскопічна робота не є функцією стану системи, оскільки залежить від способу переведення системи з початкового стану в кінцевий. Це добре видно з рис. 4.4: роботи, виконані при переході системи із стану 1 в стан 2 у процесах 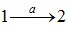 та
та  не однакові й відрізняються на величину, що чисельно дорівнює площі заштрихованої області на графіку. Тому говорять, що
не однакові й відрізняються на величину, що чисельно дорівнює площі заштрихованої області на графіку. Тому говорять, що
макроскопічна робота є функцією процесу.
Теплота. Внутрішня енергія може змінюватись і без виконання роботи, наприклад, при безпосередньому контакті тіл із різною температурою.
Процес переходу внутрішньої енергії від одних тіл до інших без виконання макроскопічної роботи називається теплообміном.
У процесі теплообміну частина внутрішньої енергії гарячого тіла переходить до холодного за рахунок зіткнень між більш швидкими молекулами гарячого тіла з повільнішими молекулами холодного. Отже, можна сказати, що при теплообміні внутрішня енергія змінюється за рахунок мікроскопічної роботи, що виконується на рівні окремих молекул. Слід, одначе, зауважити, що внутрішня енергія без виконання макроскопічної роботи може змінюватися й за рахунок випромінювання, та при зміні агрегатного стану речовини (плавлення - тверднення, пароутворення - конденсація), або в хімічних реакціях (як от при горінні).
Величина внутрішньої енергії, яку отримує або втрачає система без виконання макроскопічної роботи називається кількістю теплоти Q.
Дослід свідчить, що для зміни внутрішньої енергії системи на задану величину в різних процесах потрібна не однакова кількість теплоти. Тому, як і робота,
кількість теплоти є функцією процесу.
Формулювання першого начала термодинаміки. Як видно з попереднього, коли не виконується макроскопічна робота (A′ = 0), то зміна внутрішньої енергії системи дорівнює отриманій нею кількості теплоти: ΔU = Q. При виконанні макроскопічної роботи внутрішня енергія також змінюється. Дослідним шляхом установлено, що за відсутності теплообміну зміна внутрішньої енергії системи точно дорівнює виконаній над нею макроскопічній роботі: ΔU = A′ при Q = 0. Отже, у загальному випадку
|
ΔU = Q + A′. |
(4.12) |
Це рівняння виражає перше начало термодинаміки:
зміна внутрішньої енергії довільної термодинамічної системи дорівнює сумі отриманої системою теплоти та виконаної над нею макроскопічної роботи.
Перше начало термодинаміки є законом збереження енергії, узагальненим на теплові процеси.
Для елементарного процесу (тобто, гранично малої зміни стану системи) перше начало записується так:
|
dU = δQ + δA′, |
(4.12а) |
де dU - приріст внутрішньої енергії системи, δQ і δA′ - елементарна кількість теплоти, отримана системою, та елементарна робота, виконана над нею зовнішніми тілами. Слід зауважити, що всі величини в рівняннях (4.12) і (4.12а) є алгебраїчними. Наприклад, якщо система при теплообміні передає енергію іншим тілам, то δQ < 0. Так само, якщо об’єм системи збільшується, то δA < 0.
Рівняння (4.12) і (4.12а) можна записати інакше, якщо в (4.12) і (4.12а) зовнішню роботу замінити на роботу самої системи, згідно з (4.8а). Тоді
|
δQ = dU + δA, |
(4.13) |
|
|
Q = ΔU + A. |
(4.13а) |
Відповідно до цього, можна дати інше формулювання першого начала термодинаміки:
кількість теплоти, передана системі, йде на зміну її внутрішньої енергії та на виконання системою роботи над зовнішніми тілами.
У такій редакції перше начало термодинаміки прямо вказує на можливість виконання системою макроскопічної, тобто механічної, роботи за рахунок теплової енергії. Інакше говорячи, перше начало вказує на принципову можливість перетворення енергії невпорядкованого теплового руху молекул на механічну енергію, тобто енергію руху макроскопічних тіл. На цьому ґрунтується робота так званих теплових двигунів, які складають переважну більшість двигунів, що використовуються людиною.
Історично у становленні термодинаміки як науки вирішальну роль відіграли саме дослідження, спрямовані на підвищення ефективності теплових двигунів. У цьому зв’язку принциповим є висновок, який прямо випливає з (4.13) і показує неможливість так званого вічного двигуна першого роду - пристрою, котрий міг би необмежено довго виконувати роботу, не отримуючи енергію ззовні. Справді, для будь-якої системи, що не отримує енергії від інших тіл або навколишнього середовища, перше начало термодинаміки (4.13а) набуває вигляду
ΔU + A = 0 \(\Rightarrow \) A = –ΔU = U0– Uк,
де U0 і Uк – початкова та кінцева внутрішня енергія системи, відповідно. Звідси очевидно, що максимальна робота, яку міг би виконати будь-який двигун, навіть теоретично, не може перевищити його початкову внутрішню енергію: Amax = U0. Отже, жоден двигун не може бути “вічним”, він за будь-яких умов не зможе працювати довше, ніж доки вистачить запасу внутрішньої енергії[6]. Цей висновок є настільки принциповим, що його розглядають як третє формулювання першого начала термодинаміки:
вічний двигун першого роду є неможливим.
Термодинаміка ізопроцесів. За допомогою першого начала термодинаміки можна з’ясувати істотні деталі стосовно умов здійснення та перебігу різних процесів у термодинамічних системах, зокрема, в газах. Для цього запишемо рівняння (4.13) розлогіше, врахувавши вираз для роботи системи (4.8а), і застосуємо його до різних ізопроцесів.
|
δQ = dU + PdV. |
(4.14) |
1. Ізотермічний процес (Т = const). У цьому процесі, згідно з (4.6) і (4.7), внутрішня енергія не змінюється. Тому в рівнянні (4.12 а) dU = 0, і
|
δQT = PdV = δA і QT = A. |
(4.15) |
Отже, в ізотермічному процесі вся надана системі теплота йде на виконання системою макроскопічної роботи, тобто, перетворюється на механічну енергію. При цьому виникає резонне запитання: яким чином система, отримуючи певну кількість внутрішньої енергії у формі теплоти δQ, зберігає свою температуру незмінною? При довільній зміні об’єму, дійсно, так не може бути. Але, якщо газ помістити в циліндр з ідеально теплопровідними стінками, і проводити процес квазістатично (гранично повільно), то температура скрізь буде лишатись однаковою й рівною температурі навколишнього середовища, тобто такий ідеалізований процес буде строго ізотермічним. Стискання або розширення газу за реальних умов завжди відбувається зі скінченною швидкістю, а стінки циліндра мають скінченну теплопровідність. Тому практично можна здійснювати лише наближено ізотермічні процеси.
2. Ізохорний процес (V = const). У цьому процесі робота не виконується (dV = 0), і перше начало термодинаміки (4.12а) набуває вигляду
|
δQV = dU, |
(4.16) |
або, для скінченних величин,
|
QV = ΔU = U2–U1. |
(4.16а) |
Таким чином, позаяк у газі ізохорний процес здійснюється в циліндрі із закріпленим поршнем, товнутрішня енергія змінюється лише за рахунок теплообміну при контакті системи із більш гарячими чи більш холодними тілами, або за рахунок випромінювання.
3. Ізобарний процес (Р = const). Такий процес у газі завичай здійснюється шляхом повільного нагрівання або охолодження газу в циліндрі, закритому рухомим поршнем. За таких умов газ або розширюється, або стискається так, що його тиск весь час лишається сталим і рівним сумі зовнішнього тиску на поршень і тиску, що створюється його вагою. Тому в ізобарному процесі не лише змінюється внутрішня енергія системи, а й виконується робота. Процес іде відповідно до рівняння (4.10), і, згідно з (4.12 а),
|
QP = ΔU + PdV, або QP = U2 – U1 + P(V2 - V1). |
(4.17) |
1. Чи зміниться внутрішня енергія газу в закритій посудині, якщо вона почне швидко рухатися?
2. Говорять, що внутрішня енергія є функцією стану системи, а робота та теплота – функціями процесу. Що означають ці вислови?
3. Скільки обертальних і скільки коливальних ступенів свободи має лінійна молекула вуглекислого газу О-С-О та молекула води, в якій атоми утворюють трикутник?
4. Який відсоток від повної енергії складає енергія поступального теплового руху в жорсткій та в пружній двохатомній молекулі?
5. Які існують способи зміни внутрішньої енергії системи? Що таке “кількість теплоти”?
6. В якому процесі вся отримана системою теплота йде на зміну внутрішньої енергії?
7. В якому процесі вся отримана системою теплота перетворюється на механічну роботу?
8. Коли для підвищення температури заданої кількості газу на задану величину ΔT доведеться витратити більше тепла, – нагріваючи газ при сталому тиску, чи при сталому об’ємі?
9. Чи може система виконувати механічну роботу за рахунок своєї внутрішньої енергії?
10. Чи можна перетворити всю внутрішню енергію системи на механічну роботу?
[1] У цьому контексті слід сказати, що основи термодинаміки заклав французький інженер С. Карно в дослідженнях, спрямованих на вдосконалення теплових двигунів.
[2] Тобто, такої, в якій атоми нерухомі відносно центра мас і розташовані на одній прямій.
[3] Говорити про обертання двохатомної молекули навколо третьої (власної) осі беззмістовно, оскільки атоми розглядаються як матеріальні точки.
[4] За рахунок цього, зокрема, відбувається самозагоряння паливної суміші в дизельних двигунах.
[5] Термін “макроскопічна робота” у термодинаміці вживають, аби відрізнити роботу, що виконується при переміщенні макроскопічних тіл (тут - поршня) від “мікроскопічної роботи”, що виконується силами взаємодії між окремими молекулами. Але коли це не викликає непорозумінь, слово “макроскопічна” опускають.
[6] Як показує друге начало термодинаміки (Лекція 7, п. 7.3), в дійсності навіть такої максимальної роботи не можна отримати.