ФІЗИКА ДЛЯ БАКАЛАВРІВ. МОЛЕКУЛЯРНА ФІЗИКА ТА ТЕРМОДИНАМІКА
І. ОСНОВНІ ПОЛОЖЕННЯ МКТ
У наш час дискретна молекулярна будова речовини не потребує доказів. Достатньо лише вказати, що сучасна техніка дозволяє отримувати зображення не тільки окремих молекул, а й атомів. Нагадаємо деякі основні відомості про характеристики молекул та їхній рух і взаємодію.
2. Рух молекул. Теплова рівновага та температура
1 а.о.м.= 1,660·10-27 кг.
Маса молекули (атома), виражена в а.о.м., називається відносною молекулярною (атомною) масою Мr. Атомні маси хімічних елементів указані в періодичній таблиці Менделєєва. Для наведених вище речовин вони складають, відповідно, 1,008; 12,011 та 31,988[2]. Атомні та молекулярні маси для більшості речовин близькі до цілих чисел і в практичних розрахунках заокруглюються.
Кількість речовини. Молярна маса. Деякі характеристики речовини та процеси визначаються не масою, а кількістю частинок. Це, зокрема, стосується тиску газу або хімічних реакцій. Тому в молекулярній фізиці та хімії поряд з масою широко використовують поняття кількості речовини. Мірою кількості речовини є кількість структурних частинок (атомів, молекул, іонів, тощо), яка в ній міститься. Але через величезну кількість таких частинок для вимірювання кількості речовини використовують, знов таки, відносну одиницю - моль. За означенням 1 моль - це кількість речовини, в якій міститься стільки ж частинок, як у 0,012 кг ізотопу Карбону 12С. Така кількість частинок називається сталою Авогадро й дорівнює
NA = 6,02·1023 1/моль = 6,02·1026 1/кмоль.
Кількість речовини ν виражається через кількість частинок N очевидним співвідношенням:
|
\(\nu=\frac{N}{N_{\mathrm{A}}}\) |
(1.1) |
або, через масу m,
|
\(\nu=\frac{m}{M}\), |
(1.1а) |
де М – маса одного моля речовини, яка називається молярною масою і вимірюється в кг/моль. Зрозуміло, що
|
M = m0NA, |
(1.1б) |
де m0 – маса одного атома (молекули).
Між молярною масою речовини М та відносною масою її молекул Мr існує простий числовий зв’язок:
M(кг/моль) = 10-3·Mr або M(кг/кмоль) = Mr.
Розміри молекул. Уявлення про розміри атомів і молекул можна отримати з таких простих міркувань. Вода (Н2О) масою 1 г, що складає 1/18 моля (М = 18 г/моль), займає об’єм V = 1 см3 і містить N ≈ 3·1022 молекул. Отже, на одну молекулу припадає об’єм V0 = V/N ≈ 3·10-26 м3. Оскільки в рідинах молекули розміщуються впритул одна до одної, поперечний розмір молекули можна оцінити як \( {d}\approx{(V_{0})^{1/3}}\approx{10^{-10}}\) м. Існують і точніші методи визначення розмірів молекул, які дають величини, близькі до наведеної оцінки, причому розміри молекул різних неорганічних речовин виявляються приблизно однаковими[3].
2. Рух молекул. Теплова рівновага та температура
Рух молекул. Молекули речовини завжди перебувають у стані хаотичного руху. Про рух молекул, зокрема, свідчить явище дифузії – взаємопроникнення молекул однієї речовини в іншу. Хаотичність руху молекул наочно відображає броунівський рух - безперервний невпорядкований рух дуже дрібних частинок твердої речовини, що зважені в рідині. Рух молекул як такий не зумовлений якимось причинами або процесами в речовині, він є природнім станом частинок матерії. Водночас хаотичність руху молекул має своє пояснення. Молекула, стикаючись із іншою, змінює величину та напрям своєї швидкості, причому такі зіткнення відбуваються дуже часто. До прикладу, в газі за звичайних умов відбувається ~109 зіткнень за 1 с. Тому величини швидкості та напрямки руху окремих молекул є неконтрольованими, а їхній рух - невпорядкованим (хаотичним).
Рівноважні та нерівноважні стани й процеси. Із хаотичним рухом молекул пов’язані такі фундаментальні поняття, як теплова (термодинамічна) рівновага та температура. Попри невизначеність характеристик руху (мікроскопічних параметрів) окремої молекули, їхні середні значення для всієї системи або окремих її частин, а отже й макроскопічні параметри, у кожен момент часу мають визначену величину[4]. У загальному випадку макроскопічні параметри можуть змінюватися з часом, тоді макроскопічний стан системи називається нерівноважним. Але, як свідчить дослід, якщо система є замкненою, то її макроскопічні параметри в решті-решт обов’язково набувають значень, які надалі лишаються незмінними. Такий стан системи називається рівноважним, а її перехід в рівноважний стан називається релаксацією. Те, що будь-яка ізольована система спонтанно (сама по собі) переходить у рівноважний стан, є фундаментальним законом природи.
Зміна параметрів стану системи із плином часу називається термодинамічним процесом. Як і стани, процеси можуть бути нерівноважними або рівноважними. При нерівноважному процесі всі або деякі термодинамічні параметри не мають визначеної величини для всієї системи. Наприклад, при швидкому стисканні газу в циліндрі внаслідок руху поршня тиск і температура газу будуть різними в різних місцях - найвищими біля поршня й найнижчими біля основи циліндра. Отже, такий процес є нерівноважним або нестатичним. Але, якщо поршень переміщувати дуже повільно, то внаслідок взаємодії між молекулами газу їх концентрація та середня швидкість хаотичного руху будуть устигати вирівнюватися так, що в кожен момент часу термодинамічні параметри (тиск і температура) будуть мати практично однакові значення по всьому об’єму газу. Такий процес називається рівноважним або квазістатичним. Рівноважний процес можна розглядати як неперервну послідовність рівноважних станів системи. Строго рівноважним може бути лише нескінченно повільний процес. Наприклад, для того, щоби зміна об’єму газу в циліндрі під поршнем була рівноважною (квазістатичною), треба щоб у кожен момент часу тиск газу був лише на нескінченно малу величину більшим за зовнішній тиск при розширенні і так само меншим при стисканні газу[5]. Тому напрям процесу можна змінити, змінивши в потрібний бік зовнішній тиск знов-таки на нескінченно малу величину. Як наслідок, провівши такий процес в одному, а потім у зворотному напрямі, ми повернемо газ у вихідний стан так, що в навколишньому середовищі не відбудеться ніяких змін. Процес, який має таку властивість, називається оборотним. Отже, квазістатичні процеси є оборотними. Зрозуміло, що такі процеси є ідеалізацією - усі реальні процеси є необоротні. Проте, не рідко, вирівнювання параметрів у системі відбувається швидко. Наприклад, у газах релаксація йде приблизно із швидкістю звуку. Тому реальні процеси часто можна з достатньою точністю розглядати як оборотні (квазистатичні).
Температура. Індикатором стану термодинамічної рівноваги системи є температура[6]. Якщо система не є рівноважна, то різні її частини (тіла) мають не однакову температуру, але в процесі релаксації більш гарячі тіла охолоджуються, а холодні нагріваються. Відтак, у стані термодинамічної рівноваги температура всіх тіл будь-якої системи або різних частин одного тіла стає однаковою. Слід наголосити, що температура є єдиним термодинамічним параметром, який має вказану властивість. Наприклад, у системі, що складається з декількох гумових кульок із газом і перебуває в стані термодинамічної рівноваги, тиск газу та концентрація молекул у різних кульках може бути різною, але температура - обов’язково є однаковою й рівною температурі навколишнього повітря. Для практичного вимірювання температури використовують якусь залежну від температури властивість певної речовини (“термометричного тіла”) і відповідну температурну шкалу. Так, у побуті найчастіше користуються рідинними термометрами, дія яких ґрунтується на тому, що об’єм термометричної рідини (спирт або ртуть) лінійно залежить від температури в необхідному для практичних потреб інтервалі значень. При цьому найпоширенішою є шкала Цельсія, в якій початок відліку (0 °С) відповідає температурі тверднення води при нормальному атмосферному тиску, а температура кипіння води приймається рівною 100 °С. Є й інші температурні шкали такого типу (шкала Реомюра, шкала Фаренгейта), які відрізняються вибором нульової точки (початку відліку) та розміром одиниці температури.
Згадані температурні шкали не відображають фізичної природи температури, але виражають її зручними для практики умовними числами. Але в науці найчастіще використовують так звану абсолютну термодинамічну шкалу температур або шкалу Кельвіна. Одиниця температури в цій шкалі називається кельвін (К), а температура, виміряна в кельвінах, називається абсолютною температурою. Абсолютна температура Т є пов’язана із температурою t в шкалі Цельсія співвідношенням Т = 273,15 + t. На практиці перший доданок округлюють до цілого і приймають
Т = 273 + t.
Звідси випливає, що розмір одиниці в обох шкалах однаковий і температурі Т = 0 К, яка називається абсолютним нулем, у шкалі Цельсія відповідає температура -273 оС.
Шкала Кельвіна має глибокий фізичний зміст, який розкриває молекулярно-кінетична теорія. Розглянемо молекулярний механізм установлення термодинамічної рівноваги в теплоізольованому циліндрі, що розділений тонкою теплопровідною перегородкою та заповнений газом. Нехай початковий стан газу є нерівноважним, і молекули по обидва боки від перегородки мають різні середні швидкості хаотичного руху. Молекули обох газів стикаються з молекулами перегородки, через що кінетична енергія більш швидких молекул зменшується, а повільних - збільшується. Позаяк в одній частині циліндра кількість швидких молекул більша, ніж в іншій, то через перегородку встановиться потік енергії від газу з у середньому більш швидкими молекулами до газу з повільнішими молекулами. Очевидно, що цей процес триватиме доти, доки не зрівняються середні кінетичні енергії поступального руху молекул газу в одній та в інший частині циліндра. Після цього макроскопічний стан газу в обох частинах буде лишатися незмінним, тобто система перейде в рівноважний стан. Але, як відомо з досліду, так само поводиться й температура. При встановленні рівноваги температура газу в одній частині циліндра знижується, а в іншій - підвищується, доки в усій системі не встановиться однакова температура. Отже, можна зробити висновок про те, що температура пов’язана з хаотичним рухом молекул так, що тіло з більш високою температурою має більшу середню кінетичну енергію молекул[7]. У молекулярно-кінетичній теорії доводиться, що цей зв’язок є універсальним і виражається формулою
|
\(\left\langle{E}\right\rangle=\frac{3}{2}kT \), |
(1.2) |
де \(\left\langle{E}\right\rangle \) - середня кінетична енергія поступального теплового руху однієї молекули, k = 1,38·10-23 Дж/К - універсальна стала, що називається сталою Больцмана, Т - абсолютна температура. Це співвідношення розкриває зміст абсолютного нуля температури:
Т = 0 К - то є температура, при якій припиняється тепловий рух частинок речовини[8].
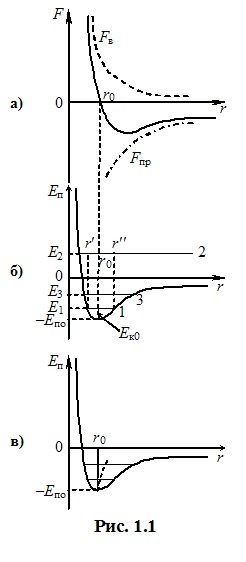 Окрім потенціальної енергії взаємодії Еп кожна молекула має також кінетичну енергію теплового руху Ек та відповідну повну енергію Е = Еп + Ек, яка не змінюється при русі молекули без зіткнення з іншою (горизонтальні лінії Е1, Е2, Е3 на рис 1.1б). Глибина потенціальної ями Еп0 визначається тільки природою молекул і для різних речовин суттєво відрізняється. Кінетична енергія теплового руху молекул Ек0 не залежить від речовини і визначається тільки її температурою. Тому спостерігаються три характерні ситуації.
Окрім потенціальної енергії взаємодії Еп кожна молекула має також кінетичну енергію теплового руху Ек та відповідну повну енергію Е = Еп + Ек, яка не змінюється при русі молекули без зіткнення з іншою (горизонтальні лінії Е1, Е2, Е3 на рис 1.1б). Глибина потенціальної ями Еп0 визначається тільки природою молекул і для різних речовин суттєво відрізняється. Кінетична енергія теплового руху молекул Ек0 не залежить від речовини і визначається тільки її температурою. Тому спостерігаються три характерні ситуації.
1) Сили взаємодії між молекулами великі, тоді Ек0 << Еп0 і повна енергія на рис. 1.1б зображується горизонтальною лінією 1. У такому випадку середня відстань між молекулами має певну величину r0, і вони лише здійснюють малі коливання навколо положень рівноваги. Така поведінка молекул спостерігається в твердих тілах, для яких є характерними здатність зберігати свою форму, твердість і велика механічна міцність.
2) Якщо сили взаємодії між молекулами малі, так що Ек0 > Еп0, то за рахунок своєї кінетичної енергії одна молекула може віддалитися від іншої на необмежену відстань. Така ситуація спостерігається в газах і зумовлює їхні характерні властивості – здатність займати весь наданий об’єм і порівняно легко стискатись.
3) Найскладнішим є молекулярний рух у рідинах. У рідинах глибина потенціальної ями лише трохи більша за середню кінетичну енергію теплового руху молекул і лінія повної енергії займає положення 3 на рис. 1.1б. За таких умов молекули рідини, в основному, здійснюють коливання навколо положень рівноваги як і в твердому тілі. Цим пояснюється те, що рідини зберігають свій об’єм і є майже нестисливими. Але, на відміну від твердого тіла, в рідині завжди присутня помітна кількість “гарячих” молекул, які мають більшу, ніж середня, кінетичну енергію і здатні подолати силу притягання до сусідніх молекул. Такі молекули час від часу переміщуються на декілька міжатомних відстаней (“кочують”) і займають нові рівноважні положення. Завдяки цьому рідина має текучість, і набуває форму посудини, в якій знаходиться.
Наявністю “гарячих” молекул пояснюється й пароутворення, тобто перехід рідини в газоподібний стан - пару[11]. Так само при нагріванні твердого тіла, коли кінетична енергія молекул стає достатньою для подолання жорсткого зв’язку між молекулами, спостерігається плавлення - перехід речовини з твердого стану в рідкий.
Демонстрація теплового руху та взаємодії молекул.
Теплове розширення. Особливості взаємодії між молекулами пояснюють і добре відомий ефект теплового розширення. Він спостерігається через неоднакову залежність сил притягання та відштовхування від відстані між молекулами, крива потенціальної енергії (потенціальна яма) на рис. 1.1б є асиметричною – її права стінка йде більш полого, ніж ліва. Тому при зростанні температури та кінетичної енергії збільшується не тільки амплітуда коливань молекул навколо положень рівноваги, а й середня відстань між ними r = (r′ + r″)/2 (штрихова крива на рис. 1.1в). Саме це є причиною збільшення лінійних розмірів і об’єму рідин та твердих тіл. При порівняно невисоких температурах середня відстань між молекулами змінюється пропорційно до температури, тому лінійні розміри \({l}\) і об’єм \({V}\) тіл лінійно залежать від температури:
\({l=l_0\left(1+\alpha{t{}^\circ}\right)}\),
\({V=V_0\left(1+\beta{t{}^\circ}\right)}\),
де \({l_0},\,\,{V_0}\) – розміри та об’єм при температурі t = 0 °C, α, β – коефіцієнти лінійного та об’ємного розширення, відповідно, причому β = 3α.
Контрольні запитання
1. Які методи дослідження використовуються в молекулярній фізиці? В чому полягає їхня сутність?
2. Що означають терміни “мікроскопічні параметри” та “макроскопічні параметри”?
3. Які одиниці використовують для визначення мас атомів і молекул? Як вони пов’язані муж собою?
4. У чому полягає відмінність між кількістю та масою речовини та як вони пов’язані між собою?
5. Який зв’язок існує між молярною масою речовини та масою однієї молекули, якщо остання виражена в кг і в а.о.м.?
6. Як можна оцінити розміри молекул у рідині через її молярну масу та густину? Чи придатний такий спосіб для твердих тіл? газів?
7. Який фізичний зміст мають поняття “температура” та “абсолютний нуль” температури?
8. У посудині з газом, яка рухається, середня кінетична енергія молекул більша, ніж у нерухомій. Чи означає це, що й температура газу в рухомій посудині вища? Чому?
9. Що таке “термодинамічна рівновага”? Чи є зв’язок між нею та механічною рівновагою?
10. Який характер мають сили взаємодії між атомами та молекулами? Наведіть наочні свідчення існування сил притягання та сил відштовхування між молекулами.
11. Відомо, що дві зіставлені поверхнями гладенькі плоскі пластинки не пристають одна до одної, тоді як дві відполіровані до дзеркального блиску пластинки “склеюються” так, що їх важко відірвати одна від одної. Чому?
12. Чому існують різні агрегатні стани речовини – твердий, рідкий та газоподібний?
13. Чому одна й та сама речовина може перебувати в різних агрегатних станах?
14. Як змінюються розміри тіл при зміні температури? З якою особливістю сил взаємодії між молекулами це пов’язано?
[1] Ізотопи - то є різновиди атомів даного хімічного елемента, що відрізняються кількістю нейтронів у ядрі.
[2] Найменування “а.о.м.”не пишуть.
[3] Це означає, що молекули не можна розглядати просто як зіставлені докупи декілька кульок-атомів. Чому так, пояснює квантова механіка.
[4] Детальніше про це буде сказано при розгляді розподілу Максвелла-Больцмана
[5] Зрозуміло, що це можливо тільки за відсутності будь-якого тертя між поршнем і циліндром.
[6] Суб’єктивно температура пов’язується із відчуттям нагрітості - чим гарячіше тіло, тим вища його температура.
[7] Тому хаотичний рух частинок речовини називають тепловим рухом.
[8] Температура 0 К є граничною величиною: температура реальної фізичної системи може лише наближатися до абсолютного нуля, ніколи не досягаючи його точно. Крім того абсолютний нуль температури означає припинення не будь-якого , а лише теплового руху частинок. Зокрема, при 0 К зберігається рух електронів в атомах і коливання атомів у молекулах (так звані нульові коливання).
[9] Їх називають силами Ван-дер-Ваальса.
[10] Так відбувається тому, що ця робота дорівнює спаду потенціальної енергії (див. МЕХАНІКА, розділ ІV).
[11] Теоретично пароутворення відбувається і в твердих тілах, але в твердому тілі кількість молекул, кінетична енергія котрих достатня для подолання зв’язку з іншими та виходу за межі тіла, є гранично малою.