ФІЗИКА. Вчимося розв'язувати задачі. "СУЧАСНА ФІЗИКА". Компенсаційний курс
Приклади розв'язування задач
Нижче наведено декілька прикладів використання постулатів Бора для розв'язування задач про найпростіший з атомів – атом водню. Принагідно відмітимо, що борівська теорія атома є напівкласичною: випромінювання та поглинання енергії в ній визначається квантовими постулатами, а рух електрона навколо ядра розглядається за законми класичної механіки.
Задача 3.1. За одним із постулатів Бора електрон в атомі може рухатися тільки по колових орбітах, на яких добуток його імпульсу та довжини орбіти є кратний до сталої Планка: \(mv\cdot{2}\pi{r}=nh\), n = 1, 2, 3, … , де n – номер орбіти. Виходячи з цього, знайти кутову швидкість електрона \(\omega\) на другій орбіті (n = 2) в атомі водню.
Задача 3.2. За певних умов збудження спектр випромінювання атома водню містить тільки N = 3 лінії. Визначити їхню довжину хвилі \(\lambda_{1}\), \(\lambda_{2}\) і \(\lambda_{3}\).
Задача 3.3. Збуджені атоми водню знаходяться на n-ому енергетичному рівні. Визначити повну кількість ліній N, що спостерігаються у їхньому спектрі випромінювання.
Задача 3.4. Електрон у нерухомому вільному атомі водню знаходиться на першому збудженому енергетичному рівні (n = 2). Визначити, якої швидкості v набуде атом при переході в основний стан.
Задача 3.5. Розглядаючи атоми як звичайні кульки, визначити, за якої найменшої відносної швидкості $v$ при непружному лобовому зіткненні двох атомів водню один із них випустить фотон.
Задача 3.1
За одним із постулатів Бора електрон в атомі може рухатися тільки по колових по колових орбітах, на яких добуток імпульсу електрона та довжини орбіти є кратний до сталої Планка:
|
\(mv\cdot{2}\pi{r}=nh\), n = 1, 2, 3, …, |
(1) |
де n – номер орбіти. Виходячи з цього,
знайти
кутову швидкість електрона \(\omega\) на другій орбіті (n = 2) в атомі водню.
|
Дано: \(mv\cdot{2}\pi{r}=nh\)
n = 2
|
|
ω - ?
|
Розв’язання
В теорії Бора рух електрона в атомі водню розглядається як рух точкового заряду по колу навколо ядра під дією кулонівської сили. Тому згідно з другим законом Ньютона та формулами (ч.3, (1.5)) і (ч.1, (1.28)) можна записати:
|
$\frac{k{{e}^{2}}}{{{r}^{2}}}=m{{\omega }^{2}}r\quad \Rightarrow \quad k{{e}^{2}}=m{{\omega }^{2}}{{r}^{3}}$, |
(2) |
де \(\omega\) – кутова швидкість електрона, m – його маса, e – заряд електрона та ядра, і k – таблична константа, що складає $k=(1/4\pi {{\varepsilon }_{0}})$ $=$ 9·109 (Нм2/Кл2).
Відтак, зробивши у виразі (1) заміни $v=\omega r$ і $h=2\pi \hbar $, де $\hbar =1,05\cdot {{10}^{-34}}$, отримаємо систему рівнянь
\(\left\{ \begin{matrix}n\hbar=m\omega{r}^{2} \\ m\omega^{2}r^{3}=ke^{2} \\ \end{matrix} \right.\)
і, виключивши з неї r, — загальну відповідь задачі:
$\omega =\frac{{{k}^{2}}{{e}^{4}}m}{{{n}^{3}}{{\hbar }^{3}}}$.
Звідси, з урахуванням характеристик електрона \(e=1,6\cdot{10}^{-19}\) Кл і $m= 9,1\cdot {{10}^{-31}}$ кг, виходить:
$\omega =5,2\cdot {{10}^{15}}$$\frac{рад}{с}$.
Задача 3.2
За певних умов збудження спектр випромінювання атома водню містить тільки N = 3 лінії.
Визначити
їхню довжину хвилі \(\lambda_{1}\), \(\lambda_{2}\) і \(\lambda_{3}\).
|
Дано: N = 3 |
|
λ1, λ2, λ3 - ?
|
Розв’язання
Атом випромінює світло при переході електрона із збудженого енергетичного рівня на будь-який нижчий. Враховуючи це, легко бачити, що за умовою для найвищого збудженого рівня головне квантове число n = 3, бо лише в такому випадку є тільки три можливі переходи електрона: з третього й другого рівнів на перший та з третього на другий. Через це й у спектрі випромінювання спостерігається тільки три частоти, що визначаються формулою Бальмера (3.6) і три відповідні довжини хвилі. Отож, підставляючи у вираз (3.6) величину сталої Рідберґа (3.7) та відповідні пари значень n – (3, 1), (2, 1) і (3, 2), – 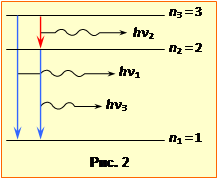 отримаємо частоти
отримаємо частоти
\(\nu_{1}=3,29\cdot{10}^{15}\left(1-\frac{1}{9}\right)=2,93\cdot{10}^{15}\) Гц,
\(\nu_{2}=3,29\cdot{10}^{15}\left(1-\frac{1}{4}\right)=2,47\cdot{10}^{15}\) Гц.
\(\nu_{3}=3,29\cdot{10}^{15}\left(\frac{1}{4}-\frac{1}{9}\right)=4,58\cdot{10}^{14}\) Гц
та шукані довжини хвилі $\lambda =(c/\nu )$ спектральних ліній:
\(\lambda_{1}=\frac{c}{\nu_{1}}=\frac{3\cdot{10}^{8}}{2,93\cdot{10}^{15}}=102,7\) нм;
\(\lambda_{2}=\frac{c}{\nu_{2}}=\frac{3\cdot{10}^{8}}{2,47\cdot{10}^{15}}=121\) нм;
\(\lambda_{3}=\frac{c}{\nu_{3}}=\frac{3\cdot{10}^{8}}{4,58\cdot{10}^{14}}=656\) нм.
Задача 3.3
Збуджені атоми водню знаходяться на n-ому енергетичному рівні.
Визначити
повну кількість ліній N, що спостерігаються у їхньому спектрі випромінювання.
|
Дано: n
|
|
N - ?
|
Розв’язання
 Задля наочності на рис. 3 схематично показано енергетичні рівні, на які може переходити електрон атома з n-ого збудженого рівня.
Задля наочності на рис. 3 схематично показано енергетичні рівні, на які може переходити електрон атома з n-ого збудженого рівня.
Відповідь задачі легко отримати, прямо підрахувавши всі можливі переходи електрона на кожен з рівнів від першого до (n –1)-го.
Очевидно, що кількості Nі таких переходів складають:
на перший рівень — N1 = n – 1,
на другий — N2 = n – 2,
на третій — N3 = n – 3,
· · ·
на (n - 1)-й — Nn-1 = 1.
Отримана числова послідовність утворює арифметичну прогресію. Тож за відомою алгебраїчною формулою сумарна кількість можливих переходів, отож і спектральних ліній, дорівнює
$N=\frac{{{N}_{1}}+{{N}_{n-1}}}{2}\left( n-1 \right)=\frac{n\left( n-1 \right)}{2}.$
Задача 3.4
Електрон у нерухомому вільному атомі водню знаходиться на першому збудженому енергетичному рівні (n = 2).
Визначити,
якої швидкості v набуде атом при переході електрона в основний стан.
|
Дано: \(n=2\)
|
|
v - ?
|
Розв’язання
Перехід атома із збудженого в основний стан супроводжується випромінюванням фотона й відбувається спонтанно (без зовнішнього впливу), отже без зміни енргії та імпульсу. Тому при випусканні фотона атом отрмує такий самий, як у фотона, за величиною й протилежний за напрямком імпульс ''віддачі'':
${{\vec{p}}_{а}}=-{{\vec{p}}_{ф}}$
Отже, враховуючи формулу (2.4), швидкість, яку отримує атом, дорівнює
| $v=\frac{\varepsilon }{mc}$, |
(1) |
де m – маса атома водню, а ε – енергія фотона, що випромінюється.
Величина ε дорівнює різниці енергій атома водню (формула (3.5a)) у збудженому (n = 2) та основному (n = 1) стані й складає:
|
\(ε=E_{0}\left(\frac{1}{n_{1}^{2}}-\frac{1}{n_{2}^{2}}\right)=\frac{3E_{0}}{4}\). |
|
Підставивши цю величину у вираз (1), отримаємо загальну відповідь:
$v=\frac{3{{E}_{0}}}{4{{m}_{a}}c}$.
Відтак урахуємо, що маса атома водню практично збігається із масою протона 1, 67·10–27 кг, і Е0 = 13,6 еВ = 2,2·10–18 Дж, і дістанемо числову відповідь:
v ≈ 3,3 м/с.
Примітка. При розв'язуванні не враховувалося, що при переході зі збудженого в основний стан вільний атом отримує від фотона не лише імпульс віддачі, а й відповідну кінетичну енергію. Але це ніяк не вплинуло на коректність і точність відповіді. Справді, при переході атома з першого збудженого стану в основний енергія випущеного фотона згідно з формулами (3.1) і (3.6) дорівнює 12,5 еВ, тоді як кінетична енергія 10–7 еВ. Тож можна сказати, що ''для фотона атом заввжди є нерухомим''.
Задача 3.5
Розглядаючи атоми як звичайні кульки,
визначити,
за якої найменшої відносної швидкості $v$ при непружному лобовому зіткненні двох атомів водню один із них випустить фотон.
Розв’язання
Згідно з умовою, в задачі не враховується хімічний зв'язок між атомами H і вважається, що при непружному зіткненні вони просто ''склеюються'' без зміни власних властивостей, а не утворюють молекулу H2. В такому разі завдання полягає у визначенні відносної швидкості атомів, за якої при зіткненні один із них перейде у збуджений стан із наступним випроміненням фотона.
Шукана величина $v$ є швидкістю руху одного атома відносно іншого, котрий задля зручності будемо вважати нерухомим. Тоді за законом збереження імпульсу
|
$mv=2m{{v}_{1}}\quad \Rightarrow \quad {{v}_{1}}=\frac{v}{2}$, |
(1) |
де $m$ – маса атома і ${{v}_{1}}$ – швидкість атомів після зіткнення.
При пружних зіткненнях зберігається не лише імпульс, а й кінетична енергія. Але при непружних зіткненнях кульок частина їхньої кінетичної енергії переходить у внутрішню. Для звичайних кульок наслідком цього є нагрівання, а для атомів – перехід у збуджений стан із наступним випромінюванням фотона з енергією
$\varepsilon =\frac{m{{v}^{2}}}{2}-\frac{\left( 2m \right)v_{1}^{2}}{2}$.
Звідси, враховуючи співвідношення (1), виходить:
|
$\varepsilon =\frac{3m{{v}^{2}}}{4}\quad \Rightarrow \quad v=2\sqrt{\frac{\varepsilon }{3m}}$. |
(2) |
Випромінювання фотона є можливе тільки після переведення атома на котрийсь із збуджених енергетичних рівнів, які для атома водню визначаються виразами (3.5) і (3.5а). Отже, шукане найменше значення v відповідає переходу атома при зіткненні з основного (n1 = 1) на перший збуджений рівень (n2 = 2) із наступним випромінюванням фотона з енергією, що за формулами (3.1) і (3.5) складає
$\varepsilon ={{E}_{1}}\left( \frac{1}{n_{1}^{2}}-\frac{1}{n_{2}^{2}} \right)=\frac{3}{4}{{E}_{1}}$.
Відтак, підставивши це значення у вираз (2), отримаємо наступну загальну відповідь
$v=\sqrt{\frac{{{E}_{1}}}{m}}$,
і, взявши до уваги значення E1= 13,6 еВ (формула (3.5а)) і масу атома H, яка практично збігається з масою протона m = 1,67·10–27 кг, знайдемо наступну числову відповідь:
v = 3,6·104 м/с.
Зауваження. На перший погляд може здатися, що в рівнянні (1) допущено помилку, позаяк воно не містить імпульсу випущеного при зіткненні атомів фотона. Але це не так, бо зіткнення атомів і випускання фотона становлять дві окремі події.