ФІЗИКА. Вчимося розв'язувати задачі. "СУЧАСНА ФІЗИКА". Компенсаційний курс
Розділ ІІІ. Будова атома
3.3. Атом Гідроґену
Згідно зпланетарною моделлю, атом водню являє собою протон навколо якого по коловій траєкторії рухається електрон. В такій моделі, спираючися на закони класичної механіки та постулати Бора, можна отримати наступні вирази для дозволених радіусів електронних орбіт
| ${{r}_{n}}=\frac{{{\hbar }^{2}}}{k{{m}_{e}}{{e}^{2}}}\cdot {{n}^{2}}$ | (3.4) |
та енергетичних рівнів атома водню:
де me, e – маса і заряд електрона, \(\hbar=1,054\cdot{10}^{-34}\) Дж·с – зведена стала Планка, $k=\left( 1/4\pi {{\varepsilon }_{0}} \right)=9\cdot {{10}^{9}}$ м/Ф – електрична стала, а параметр n = 1, 2, … визначає порядковий номер рівня й називається головним квантовим числом. Зазвичай формулу (3.5) записують у вигляді:
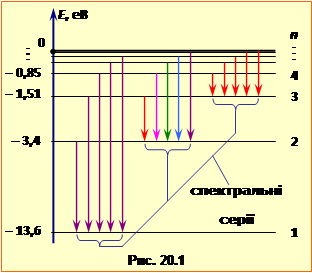
де величина ${{E}_{1}}=\frac{{{k}^{2}}{{m}_{e}}{{e}^{4}}}{2{{\hbar }^{2}}}$ = 13,6 еВ, як видно з формули й рис. 20.1, дорівнює енергії, що необхідна для переведення електрона з основного рівня n = 1 на рівень n → ∞, якому за формулою (3.4) відповідає віддалення електрона від ядра на необмежену відстань r → ∞, тобто іонізація атома. На енергетичні рівні n > 1, атом може переходити тільки внаслідок зовнішнього впливу, приміром, опромінення світлом, і називаються збудженими рівнями. Відповідні стани атома є нестабільні: в них атом перебуває тільки протягом часу \(\tau\sim{10}^{-8}\) c й потому прямо, або каскадно переходить в основний стан із випусканням низки фотонів відповідних частот та довжин хвилі, повний набір яких складає оптичний спектр атома. |
Оптичний спектр водню визначається узагальненою формулою Бальмера, що випливає з умови (3.2) та формули (3.5) і має вигляд:
де величина
називається сталою Рідберґа, а n1 і n2– номери рівнів, між якими відбувається перехід. Всі частоти випромінювання природньо групуються у спектральні серії – сукупності, що відповідають переходам електрона на заданий енергетичний рівень n1 з усіх більш високих рівнів, як схематично показано на рис. 20.1 для перших трьох серій. Частоти у спектрі поглинати визначаються тією самою формулою (3.6) із знаком ''–''. На завершення зауважимо, що борівська теорія стосується й так званих ''водньоподібних атомів'' – іонів із зарядом ядра Zе, які мають тільки один валентний електрон. Прикладом може слугувати іон $H{{e}^{+}}$, або $L{{i}^{++}}$. У такому разі в наведених формулах величину ${{e}^{2}}$ слід замінити на $Z{{e}^{2}}$. |