ФІЗИКА. Вчимося розв'язувати задачі. "СУЧАСНА ФІЗИКА". Компенсаційний курс
Розділ 20. Будова атома
20.3. Атом Ґідрогену
Постулати Бора відіграли вирішальну роль у виникненні квантової фізики. Вони пояснили деякі властивості атома Гідрогену і дозволили теоретично розрахувати його енергетичні рівні, тобто всі можливі значення енергії стаціонарних станів, і оптичні спектри, тобто всі можливі частоти, що можуть випромінювати і поглинати атоми Гідрогену.
|
Енергетичні рівні атома Гідрогену визначаються формулою
де m, e – маса і заряд електрона, \(\hbar=1,05\cdot{10}^{-34}\) Дж×с – стала Планка, \(k=\frac{1}{4\pi\varepsilon_{0}}=9\cdot{10}^{9}\) м/Ф. Величина
Тому у числовому вигляді формула (20.3) записується так:
Натуральне число n називається головним квантовим числом. Його можна розглядати як номер даного енергетичного рівня у порядку зростання енергії.
З формули (20.3б) зрозуміло, що зі збільшенням n рівні енергії зближуються і при \(n\to\infty\) зливаються, прямуючи до значення \(E_{\infty}=0\). Це означає, що атом іонізується, тобто відбувається відривання електрона від ядра. Стан n = 1 з мінімальною енергією E1 = E0 (см. вираз (20.3а)) є стійким. У цьому стані атом може перебувати нескінченно довго, тому він називається основним станом. Перейти в будь-який інший стан атом може тільки одержавши енергію ззовні. Тому всі стани з n > 1 називаються збудженими. Збуджені стани нестабільні. Атом може перебувати в збудженому стані тільки протягом малого проміжку часу \(\tau\sim{10}^{-8}\) c, по чому спонтанно (самодовільно) переходить у який-небудь стан з меншою енергією, випромінюючи фотон. Таким чином, для того щоб атоми випромінювали енергію, їх потрібно весь час яким-небудь способом переводити у збуджені стани. Наприклад, у світних трубках, що використовуються у світловій рекламі, це робиться за допомогою газового розряду, тобто електричного струму. |
|
Оптичний спектр, тобто набір усіх можливих частот, що їх можуть випромінювати атоми Гідрогену, визначається узагальненою формулою Бальмера. Ця формула випливає з умови (20.2), формули (20.3) і має вигляд:
де n2 – номер рівня, з якого відбувається перехід, n1 – номер рівня, на який відбувається перехід електрона в атомі. Величина
називається сталою Рідберга. Всі частоти природно групуються у спектральні серії. Серія – це сукупність усіх частот (спектральних ліній), обумовлених переходами на заданий рівень n1. На рис.20.1 стрілками вказані переходи, що утворять перші три серії у спектрі атомарного Гідрогену. Формула (20.4) визначає також частоти світла, що можуть поглинати атоми Гідрогену. При цьому n2 – номер рівня на який переходить електрон, а n1 – номер рівня, з якого відбувається перехід. |
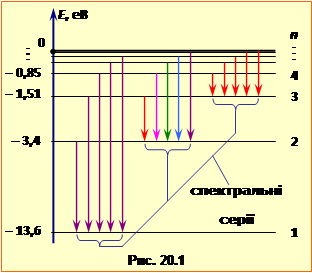 Схема розташування енергетичних рівнів атома Гідрогену показана горизонтальними лініями на рис.20.1. Для більшої наочності пропорції на рис. 20.1 дещо змінені.
Схема розташування енергетичних рівнів атома Гідрогену показана горизонтальними лініями на рис.20.1. Для більшої наочності пропорції на рис. 20.1 дещо змінені.