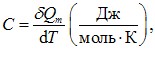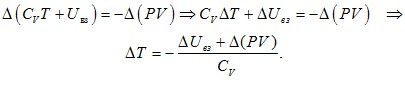ФІЗИКА ДЛЯ БАКАЛАВРІВ. МОЛЕКУЛЯРНА ФІЗИКА ТА ТЕРМОДИНАМІКА
V. ТЕПЛОЄМНІСТЬ. ПОЛІТРОПНІ ПРОЦЕСИ
Нижче мова піде про таке:
1. Теплоємності ідеального газу
1. Теплоємності ідеального газу
де δQ – отримана кількість теплоти і dT – зміни температури тіла.
Величина C0 характеризує задане тіло. Але для теорії важливо знати теплові властивості не конкретного тіла, а речовини, з якої воно складається. Для цього уводяться молярна та питома теплоємності речовини.
Молярною теплоємністю С називається теплоємність одного моля даної речовини:
|
|
(5.1) |
де \(\delta{Q_m}=\delta{Q}/\nu \) – кількість теплоти, що припадає на 1 моль, ν – кількість молів речовини, що міститься в тілі. Отже,
\({C}=\frac{C_0}{\nu}\) або \({C}=\frac{MC_0}{m}\),
де М - молярна маса речовини, т - маса тіла. Одиницею молярної теплоємності є 1 Дж/(моль·К).
Питома теплоємність с - це теплоємність одиниці маси речовини:
|
\({c}=\frac{C_0}{m}=\frac{\delta{Q}}{m\mathrm{d}T}\). |
(5.1а) |
Вона вимірюється у Дж/(кг·К) і пов’язана з молярною теплоємністю очевидним співвідношенням:
|
\({c}=\frac{C}{M}\). |
(5.2) |
У попередній лекції було з’ясовано, що в різних процесах заданій зміні внутрішньої енергії та температури тіла відповідає не однакова кількість теплоти. Тому, як і кількість теплоти,
теплоємність є функцією процесу.
Це означає, що теплоємність залежить не лише від властивостей речовини, а й від способу передачі тілу теплової енергії термодинамічній системі (“тілу”). Це випливає з першого начала термодинаміки й добре легко прослідковується в ізобарному та ізохорному процесах. Згідно з виразами (4.14) і (4.16), при наданні системі однакової кількості теплоти зміна внутрішньої енергії, тож і температури, в ізохорному процесі буде більшою, ніж в ізобарному, оскільки при незмінному об’ємі на нагрівання йде все надане тепло, а при сталому тиску – лише його частина. Інша ж частина витрачається на роботу при розширенні (зміні об’єму) тіла. Тому для збільшення температури тіла на 1 К в ізобарному процесі треба витратити більше тепла, ніж в ізохорному. Отже, для будь-якої системи теплоємності при сталому тиску CP та при сталому об’ємі CV, є не однакові, причому CP > CV. Проте, на практиці ця різниця істотна лише для газів, оскільки зміна об’єму й робота розширення при нагріванні рідин і твердих тіл є несуттєвою. Тому для рідин і твердих тіл CP і CV не розрізняють, і в довідкових таблицях їхні теплоємності наводять без указівки на процес.
Теплоємності ідеального газу CV і CP. Внутрішня енергія ідеального газу залежить тільки від температури (формули (4.6), (4.6а)). Тому його молярні теплоємності CV і CP, які посідають важливе місце в теорії, легко визначаються з першого начала термодинаміки. Згідно з означенням (5.1) та виразами (4.16) і (4.14), маємо:
|
\({C_V}=\frac{\delta{Q_V}}{\mathrm{d}T}=\frac{\mathrm{d}U}{\mathrm{d}T}\) |
(5.3) |
і
|
\({C_P}=\frac{\delta{Q_P}}{\mathrm{d}T}=\frac{\mathrm{d}U}{\mathrm{d}T}+\frac{P\mathrm{d}V}{\mathrm{d}T}\). |
(5.3а) |
Зміна внутрішньої енергії, що відповідає заданій зміні температури тіла, не залежить від процесу, то ж вираз CP можна переписати так:
|
\({C_P}=C_V+P\frac{\mathrm{d}V}{\mathrm{d}T}\), |
(5.4) |
де другий доданок визначає роботу, яку виконує 1 моль ідеального газу при ізобарному нагріванні на 1 К. Цю роботу легко визначити з рівняння Клапейрона (2.6 а) з урахуванням умови P = const:
\(\frac{\mathrm{d}V}{\mathrm{d}T}=\frac{R}{P}\) \(\Rightarrow \) \({P}\frac{\mathrm{d}V}{\mathrm{d}T}={R}\).
Отже, робота одного моля ідеального газу при його ізобарному нагріванні на 1 К чисельно дорівнює універсальній газовій сталій[2]. Таким чином, між молярними теплоємностями ідеального газу є універсальне співвідношення, яке називається рівнянням Майєра:
|
\({C_P}=C_V+R \) або \({C_P-C_V=R}\). |
(5.5) |
Що ж до самих теплоємностей, то вони залежать лише від кількості ступенів свободи молекул газу. Справді, із (5.3) і (4.6а) і (5.5) маємо:
|
\({C_V}=\frac{i}{2}{R}\) і \({C_P}=\frac{i+2}{2}{R}\), |
(5.6) |
де і – кількість ступенів свободи молекул, яка визначається виразом (4.5).
Корисно відмітити, що, згідно з отриманим виразом \({C_V}\) і формулами (4.6) і (4.6 а), внутрішня енергія ідеального газу виражається, як
|
\({U=\nu{C_V T}}\) і \({U_m}={C_V T}\). |
(5.7) |
У теорії часто використовується величина
|
\(\gamma=\frac{C_P}{C_V}\), |
(5.8) |
яка називається показником адіабати. З (5.6) випливає, що для ідеального газу
|
\(\gamma=\frac{i+2}{i}\). |
(5.8а) |
Зважаючи на останній вираз, у відповідних формулах замість кількості ступенів свободи і можна оперувати показником адіабати g. Наприклад, формули теплоємностей (5.6) та внутрішньої енергії ідеального газу (4.6) і (4.7) можна подати у вигляді:
|
\({C_V}=\frac{R}{\gamma - 1}\), \({C_P}=\frac{\gamma{R}}{\gamma -1}\); |
(5.9) |
|
|
\({U}=\frac{\nu RT}{\gamma - 1}=\frac{m}{M}\cdot\frac{RT}{\gamma-2}\); |
(5.10) |
|
|
\({U}=\frac{PV}{\gamma-1}\). |
(5.11) |
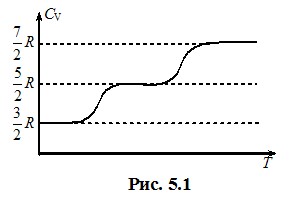
Неповнота класичної теорії теплоємностей. З формул (5.6) випливає. що теплоємності ідеальних газів визначаються тільки кількістю ступенів свободи, тобто, просторовою структурою молекул. Зокрема, для молекул виходить \({C_V}={3R/2}\) у випадку одноатомних молекул (і = 3), \({C_V}={5R/2}\) для двохатомних жорстких молекул (і = 5) і \({C_V=3R}\) для багатоатомних жорстких молекул (і = 6). Досліди свідчать, що такий прогноз, більшою чи меншою мірою, справджується тільки при не дуже низьких і не дуже високих температурах. Це ілюструє рис. 5.1, де схематично показано температурну залежність теплоємності \({C_V}\) водню Н2.
|
|
При проміжних температурах маємо очікуване для жорстких двохатомних молекул значення \({C_V}={5R/2}\). Але при охолодженні газу теплоємність починає зменшуватись і при дуже низьких температурах набуває значення \({3R/2}\), яке притаманне одноатомному газу. Аналогічно, при значному нагріванні теплоємність зростає, наближаючись до величини \({7R/2}\), яка є характерною для двохатомних пружних молекул через наявність і коливального ступеня свободи. Пояснити ці розбіжності класична фізика не здатна, оскільки вони пов’язані зі специфічними квантовими властивостями молекул та інших мікроскопічних частинок. Як показано у квантовій механіці, енергія обертального та коливального руху мікрочастинок може змінюватися тільки дискретними порціями-квантами, причому енергія квантів обертальної енергії εоб набагато менша, ніж коливальної εкол. З іншого боку, при теплообміні молекули передають одна одній енергію порядку kT. Тому при дуже низьких температурах, коли kT < εоб << εкол, обертальний рух молекул та коливальний рух атомів у них не впливають на процес теплообміну й, відповідно, на теплоємність газу. При цьому молекули поводяться, як одноатомні (і = 3, CV = 3R/2), тому говорять, що при низьких температурах обертальні та коливальні ступені свободи є “замороженими”. При підвищенні температури обертальні ступені свободи поступово починають “розморожуватись”, тобто, все більша кількість молекул H2 починає давати вклад у внутрішню енергію за рахунок не тільки поступального, а й обертального руху. Внаслідок цього теплоємність поступово підвищується до величини \({C_V=5R/2}\), що відповідає жорстким двохатомним молекулам (і = 5). Так само при дуже високих температурах “розморожується” й коливальний ступінь свободи, відтак, згідно з (4.5), i = 5 + 2iкол = 7. Через це теплоємність зростає до значення \({C_V=7R/2}\).
Окрім розглянутих раніше ізопрцесів у газах, важливу роль у термодинаміці відіграють адіабатний процес і політропні процеси, в яких змінюються всі три параметри стану: Р, V, Т.
Адіабатний процес. Так називається процес, який відбувається без теплообміну системи з навколишнім середовищем. Для такого процесу, згідно з (4.14), dU + PdV = 0. Тож, скориставшись виразом (5.11), отримаємо:
\(\frac{\mathrm{d}(PV)}{\gamma-1}+p\mathrm{d}V={0}\) \(\Rightarrow \) \(\mathrm{d}(PV)+(\gamma-1)P\mathrm{d}V={0}\) \(\Rightarrow \)
\({V}\mathrm{d}P+P\mathrm{d}V+(\gamma-1)P\mathrm{d}V={0}\) \(\Rightarrow \) \({V}\mathrm{d}P+\gamma{P}\mathrm{d}V={0}\).
Поділимо останній вираз на PV і врахуємо відоме з диференціального числення співвідношення dx/x = d(lnx). Тоді
\(\frac{\mathrm{d}P}{P}+\gamma\frac{\mathrm{d}V}{V}={0}\) \(\Rightarrow \) \(\mathrm{d}\left(\ln{P}\right)+\gamma\mathrm{d}(\ln{V})={0}\) \(\Rightarrow \) \(\mathrm{d}{(\ln{P})}+\mathrm{d}(\ln{V}^{\gamma})={0}\) \(\Rightarrow \)
\(\Rightarrow \) \(\mathrm{d}(\ln{P}+\ln{V}^{\gamma})=0 \) \(\Rightarrow \) \(\mathrm{d}(\ln{PV}^{\gamma})={0}\).
З цього виразу випливає рівняння адіабатного процесу, яке називається рівнянням Пуассона:
|
\({PV^{\gamma}}=\mathrm{const}\) |
(5.12) |
За допомогою (2.6) це рівняння можна подати і в інших змінних:
|
\({TV^{\gamma-1}}=\mathrm{const}\); |
(5.12а) |
|
|
\({TP^{\frac{1-\gamma}{\gamma}}}=\mathrm{const}\). |
(5.12б) |
Зауважимо, що показником степеня в рівнянні Пуассона є введена в попередньому пункті величина \(\gamma=C_P/C_V \), чим і пояснюється її назва “показник адіабати”.
|
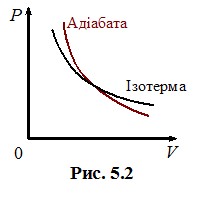
|
Адіабатний процес нагадує ізотермічний тим, що тиск і об’єм знаходяться в оберненому зв’язку. Але в адіабатному процесі зміна тиску відбувається швидше, як це показано на рис. 5.2. Крім того, в адіабатному процесі δQ = 0, і, згідно з (4.13), робота газу виконується не за рахунок теплообміну, як в ізотермічному процесі, а за рахунок зміни внутрішньої енергії системи:
\({0=}\mathrm{d}U+\delta{A}\) \(\Rightarrow \) \(\delta{A}=-\mathrm{d}U \) \(\Rightarrow \) \(\mathrm{d}U=-P\mathrm{d}{V}\).
Звідси випливає, що при адіабатному розширенні газ охолоджується, а при стисканні – нагрівається. Завдяки останньому, як уже відмічалося, відбувається самозапалювання паливної суміші в двигунах дизельного типу. Пониження температури газу при адіабатному розширенні використовується, зокрема, в кріогенній техніці та камері Вільсона – приладі, що дозволяє спостерігати траєкторії руху швидких елементарних частинок. При цьому слід зауважити, що в реальності процес у газі на може бути стого адіабатично через наявність теплообміну з довкіллям. Але при великій швидкості протікання, як у наведених прикладах, він є достатньо близьким до адіабатичного.
Але виявляється, що не будь-яке швидке розширення газу супроводжується його охолодженням. У цьому зв’язку повчальними є результати дослідів по розширенню газу в пустоту, які були здійснені Гей-Люссаком і Джоулем. У цих дослідах використовувалися два балони, що були з’єднані трубкою із закритим краном. Один балон був заповнений повітрям, а інший – відкачаний. Дослід полягав у вимірюванні температури газу до та після відкривання крана. На перший погляд результат досліду легко передбачити: після відкривання крана повітря розширюється дуже швидко, отже практично без теплообміну з оточенням (адіабатно), і тому має охолодитися. Але, навіть при високому початковому тиску, що в 20 разів перевищував атмосферний, ніякої зміни внутрішньої енергії та температури повітря при розширенні не спостерігалось. Цей “парадокс” не важко зрозуміти, взявши до уваги, що при вказаних вище значеннях тиску повітря ще поводиться, як ідеальний газ. Розширюючись у пустоту, повітря не виконує макроскопічної роботи (4.8 а), оскільки не рухає ніяких зовнішніх тіл типу поршня. Не виконується й мікроскопічна робота силами взаємодії між молекулами, оскільки їх в ідеальному газі немає. За таких умов внутрішня енергія, отже й температура повітря, при розширенні не змінюються, що й показали досліди Джоуля. Таким чином, при адіабатному розширенні ідеального газу в пустоту тиск і об’єм значно змінюються при незмінній температурі, що суперечить рівнянням адіабати (5.12 а) і (5.12 б). Але в цьому немає ніякого протиріччя, оскільки всі рівняння термодинаміки стосуються тільки рівноважних процесів, у той час як розширення газу в пустоту відбувається дуже швидко і не є рівноважним.
Політропні процеси. Теплоємність є функцією процесу і, загалом, може змінюватися в ході процесу. Але існують процеси, в яких теплоємність системи лишається сталою: С = const. Такі процеси називаються політропними (говорять також “політропічними”). Установимо рівняння політропного процесу. Для цього запишемо перше начало термодинаміки (4.14) для одного моля газу, виразивши \(\delta{Q}\) і \(\mathrm{d}U\) з (5.1) та (5.3):
\({C\mathrm{d}T}=C_V\mathrm{d}T+P\mathrm{d}{V}\) \(\Rightarrow \) \((C-C_V)\mathrm{d}T-P\mathrm{d}V={0}\).
З рівняння Клапейрона (2.6 а) випливає, що dT = d(PV)/R. Зробивши цю підстановку в попередній вираз і, ввівши позначення \(\alpha=(C-C_V)/R \), отримаємо: \(\alpha\mathrm{d}(PV)-P\mathrm{d}V={0}\). Далі, вчиняючи так, як раніше при виведенні рівняння Пуассона, дістанемо:
\({PV^{1-\frac{1}{\alpha}}}=\mathrm{const}\).
Якщо, підставити в показнику вираз \(\alpha \) і врахувати, що \({R=C_P-C_V}\), то отримаємо рівняння політропи:
|
\({PV^n}=\mathrm{const}\), |
(5.13) |
де число
|
\({n}=\frac{C-C_P}{C-C_V}\) |
(5.14) |
називається показником політропи.
Рівняння (5.13) аналогічне до (5.12), тому за аналогією з (5.12 а) і (5.12 б) можна записати:
|
\({TV^{n-1}}=\mathrm{const}\) і \({T}P^{\frac{1-n}{n}}=\mathrm{const}\). |
(5.14а) |
До політропних належать усі розглянуті раніше процеси. Справді, ізобарний процес Р = const задовольняє рівнянню (5.13) при п = 0, для ізотермічного процесу PV = const і п = 1, для адіабатного– \({n=\gamma}\) . Нарешті, якщо (5.13) переписати у вигляді \({P}^{1/n}V=const \) , стане зрозуміло, що ізохорний процес V = const теж формально можна розглядати як політропний з \( n\to \infty \) . Формула (5.14) дозволяє виразити теплоємність системи в будь-якому політропному процесі через показник політропи:
|
\({C}=\frac{nC_V-C_P}{n-1}\). |
(5.15) |
З цієї формули випливає, що в ізотермічному процесі (п =1) теплоємність \({C}\to \infty \) , що природно, оскільки для цього процесу у виразі (5.1) dT = 0. Для адіабатного процесу n = γ і з (5.15) виходить С = 0. Це теж зрозуміло, адже в цьому процесі δQ = 0. Але для всіх політропних процесів, проміжних між ізотермічним та адіабатним, із формули (5.15) випливає, що С < 0. Щоб переконатися в цьому досить у (5.15) зробити заміну CP = γCV і врахувати, що для таких процесів n < γ. Цей висновок може здатися несподіваним, але в ньому немає нічого парадоксального. Він означає тільки те, що в подібних процесах газ весь час виконує більшу роботу, ніж отримувана ним кількість теплоти. З цієї причини внутрішня енергія зменшується і газ охолоджується, тож dT < 0 i C < 0.
Робота газу в політропних процесах. Найзагальнішим способом обчислення роботи в термодинаміці є визначення інтегралів (4.9). Але для політропного процесу із заданим показником політропи це можна зробити легше за допомогою першого начала термодинаміки (4.13а), згідно з яким A = Q – ΔU. Виразивши Q i ΔU через теплоємності за формулами (5.1) і (5.3), отримаємо для одного моля A = (C - CV)ΔT і для \({\nu}\) молів
|
\({A}=\nu (C-C_V)\Delta{T}\). |
(5.16) |
Різницю теплоємностей легко виразити через показник політропи з (5.14):
\({n}=\frac{C-C_P}{C-C_V}=\frac{(C-C_V)+C_V-C_P}{C-C_V}=1-\frac{R}{C-C_V}\) \(\Rightarrow \) \({C-C_V}=-\frac{R}{n-1}\).
Підставивши цей вираз у (5.16), отримаємо
|
\({A}=\frac{\nu{R}(T_1-T_2)}{n-1}\), |
(5.17) |
або, з урахуванням (2.6),
|
\({A}=\frac{P_1V_1-P_2V_2}{n-1}\). |
(5.17а) |
Слід зауважити, що ці вирази не можна використовувати для ізотермічного процесу (п = 1), оскільки і чисельники, і знаменники дорівнюють нулю.
Усі конкретні питання, пов’язані з першим началом термодинаміки, розглядалися вище на прикладі ідеальних газів. Термодинаміка процесів у реальних газах є значно складнішою. Це зумовлено тим, що у внутрішню енергію реального газу, крім кінетичної, входить ще й потенціальна енергія взаємодії між молекулами Uвз. Остання залежить від відстані між молекулами, тобто, від об’єму газу. Тому при адіабатній (без обміну енергією із зовнішніми тілами) зміні об’єму реального газу має змінюватись не тільки потенціальна, а й кінетична енергія молекул, отже – температура газу. Причому, на відміну від ідеального газу, в реальних газах температура має змінюватись і при розширенні в пустоту, коли зміна об’єму газу не супроводжується виконанням роботи.
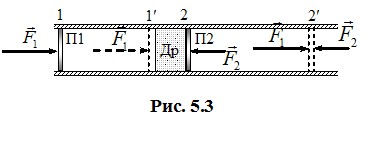
Ефект зміни температури при адіабатному розширенні газу в пустоту виявили Джоуль і Томсон, які здійснили дослід за схемою рис. 5.3. Теплоізольована труба розділяється на дві половини “дроселем” Др (пористим корком), по обидва боки від якого розміщені рухомі нетеплопровідні поршні П1 і П2. У початковому стані поршень П2 прилягає до дроселя, а об’єм між поршнем П1 і дроселем заповнений газом. Зовнішні тиски на поршні однакові і дорівнюють тиску газу між поршнем П1 і дроселем. Дослід полягає в повільному продавлюванні газу крізь дросель за рахунок невеликої додаткової сили, прикладеної до поршня П1. При цьому обидва поршні переміщуються з положень 1, 2 в положення 1′, 2′. Такий процес називається “дроселюванням”, або процесом Джоуля-Томсона.
|
|
При повільному переміщенні поршнів дроселювання можна вважати рівноважним (квазістатичним) процесом, так що тиск і температура газу в кожній половині труби (P1, T1) і (P2, T2) лишаються сталими, причому P1 > P2. Застосуємо до цього процесу перше начало термодинаміки (4.12), урахувавши відсутність теплообміну:
ΔU = A′,
де робота A′ складається з робіт \( {A}_{1}^{\prime}\) і \( {A}_{2}^{\prime}\), що їх виконують над газом сили зовнішнього тиску на поршні:
\( {A}^{\prime}=A_{1}^{\prime}+A_{2}^{\prime}\).
Позначивши початковий об’єм зліва V1 і кінцевий об’єм праворуч V2, на основі (4.10а) маємо: \( {A}_{1}^{\prime}=P_{1}V_{1}\) і \( {A}_{2}^{\prime}=-P_{2}V_{2}\). Відтак зміна внутрішньої енергії виражається, як
|
ΔU = A′ = P1V1 – P2V2 \( \Rightarrow \) ΔU =–Δ(PV). |
(5.18) |
Без урахування енергії взаємодії між молекулами Uвз, тобто, за умови ідеальності, внутрішня енергія одного моля газу, згідно з (5.7), U = CVT. Отже, для моля реального газу
U = CVT + Uвз.
Підставивши цей вираз в (5.18), отримаємо:
|
|
(5.19) |
Таким чином, при описаному розширенні в пустоту реального газу температура має змінюватись. Це явище, яке дійсно спостерігається, називається ефектом Джоуля-Томсона, а співвідношення (5.19) є його загальним аналітичним виразом. Для отримання конкретного виразу ΔT треба мати конкретну модель газу, тобто, явні вирази енергії взаємодії між молекулами та рівняння стану газу. Але деякі особливості ефекту Джоуля-Томсона можна з’ясувати й на основі загальних міркувань. По-перше, в процесі Джоуля-Томсона поршні виконують зовнішню роботу \( {A}_{1}^{\prime}\) і \( {A}_{2}^{\prime}\). Тому може здатися, що саме ця робота є причиною зміни температури, і ніякого “ефекту”, власне, немає. Аби відкинути такий сумнів, застосуємо вираз (5.19) до ідеального газу, для якого ΔUвз = 0 і, згідно з (2.6а), \(\Delta (PV)=R\Delta{T}\). Тоді вийде:
\(\Delta{T}=-\frac{R\Delta{T}}{C_V}\) \(\Rightarrow \) \((C_V+R)\Delta{T}={0}\) \(\Rightarrow \) \(\Delta{T}={0}\).
Отже, зміна температури в ефекті Джоуля-Томсона зумовлена саме “неідеальністю” газу. По-друге, для різних газів і при різних тисках і температурах кожен доданок і весь чисельник (5.19) можуть мати різні знаки. Тому температура газу при дроселюванні може як зменшуватися, так і збільшуватися, а в окремих випадках і лишатися незмінною. Практика підтверджує такий прогноз: для кожного газу існує своя температура інверсії, при переході через яку ефект змінює знак.
Наостанок, укажемо, що можливість зменшення температури при дроселюванні використовують у промисловості для скраплення газів і отримання дуже низьких (“кріогенних”) температур.
2. Чи можна твердити, що теплоємність визначається тільки властивостями речовини тіла?
3. Чому в довідниках фізичних характеристик матеріалів є таблиці теплоємностіей для рідин і твердих тіл, але немає – для газів?
4. Чи може теплоємність системи бути від’ємною?
5. Що таке ізохорна теплоємність CV та ізобарна теплоємність системи CP? Чому ізобарна теплоємність більша за ізохорну? На скільки?
6. Що таке показник адіабати? Отримайте формули (5.9) – (5.11).
7. Який процес називається адіабатним? Наведіть різні варіанти запису рівняння адіабати.
8. Як змінюється температура газу в адіабатному процесі? Чи може зменшуватися температура при стисканні газу?
9. Відомо, що при швидкому (адіабатному) розширенні ідеального газу в пустоту його температура не змінюється. Чому?
10. Які процеси називаються політропними? Як пов’язані між собою тиск та об’єм газу в політропному процесі?
11. Отримайте рівняння політропи (5.13) і (5.14а).
12. У чому полягає ефект Джоуля-Томсона? Чому він не спостерігається в ідеальних газах?
[1] Виняток становить тільки ізотермічний процес, у якому внутрішня енергія та температура лишаються незмінними.
[2] Це можна розглядати як термодинамічне означення універсальної газової сталої.